O que é um Sistema Validável (ANVISA)?
No Guia de Validação de Sistemas Computadorizados, a ANVISA destaca que “A comprovação da qualidade e segurança de um sistema computadorizado não deve se restringir a realização de testes. Para confirmar o correto funcionamento de um software, e suas interações com o hardware, devem ser contemplados aspectos relacionados a infraestrutura, segurança, manutenção de dados, dentre outros” (ANVISA, Pág 9). Isso se aplica à validação de um sistema e neste post vamos pontuar a que se refere esta denominação.
O que é um Sistema Validável?
A validação é um protocolo realizado junto à empresa que contratam um sistema, seja ele um equipamento, software ou o conjunto disso. Da etapa inicial, que vai desde a prospecção de soluções, até a etapa de pós-instalação e funcionamento completo, tudo precisa ser registrado. O resultado disso é uma série de documentos que validam o sistema para a operação que a instituição necessita. Para ANVISA, aplicações online também se caracterizam como um ‘tipo de software’ e também podem ser validáveis, apesar de não se encontrar instalado em máquinas e sim obtendo acesso de qualquer ambiente, computador ou celular.
Importante ressaltar! Por mais que a sua instituição receba uma documentação já pronta dos fabricantes de equipamentos ou de prestação de serviços (software), cabe aos responsáveis pela empresa analisar, avaliar e revisar todos os procedimentos do software/aplicação e desenvolver as particularidades para concluir a Validação/Qualificação, conforme as orientações dos órgãos reguladores, junto aos responsáveis pelos equipamentos e/ou serviços.
Do que se constitui um Sistema Validável?
No Guia proposto pela Anvisa, e que mencionamos no incio do post, consta que “A empresa deve possuir uma lista contendo todos os sistemas computadorizados instalados e suas respectivas avaliações de criticidade”. Isso se aplica tanto a sistemas novos quanto a sistemas legados, ou seja, sistemas especialmente desenvolvidos para empresas ou sistemas que já existiam previamente e que foram adaptados às necessidades em questão.
Este processo de documentação contempla especificidades distintas para cada um dos casos. No entanto, para que um sistema seja validável, determina-se que “todo sistema que substituir operações manuais e que tenha sido classificado como relevante em relação às Boas Práticas (BPx) deve atender, no mínimo, aos seguintes requisitos para ser considerado como validável”:
- Documentação que descreva as necessidades do usuário em relação ao negócio;
- Especificação Técnica/Funcional;
- Descrição do sistema;
- Análise de riscos e avaliação de criticidade do sistema;
- Avaliação documentada do histórico do sistema;
- Capacidade de armazenamento de dados críticos de operações ou controles;
- Controle para que entradas e modificações de dados sejam realizadas apenas por pessoas autorizadas;
- Capacidade de registrar tentativas de acesso por pessoas não autorizadas;
- Capacidade de registrar os acessos autorizados, incluindo usuário, hora e data;
- Manutenção dos registros de todas as entradas e alterações quando houver alteração de dados;
- Possibilidade de impressão dos dados armazenados eletronicamente;
- Inviolabilidade e proteção dos dados históricos, tanto de processo ou operações, quanto de rastreabilidade de modificações feitas pelo operador do sistema (por meios eletrônicos contra danos acidentais ou intencionais);
- Possibilidade de realização de backup em intervalos regulares.
Quanto ao ciclo de tempo, as atividades para tornar um sistema validável incluem:
- Conceito: varia de empresa para empresa, mas quanto mais formalizada essa fase estiver, mais consistente estará a base de recursos.
- Projeto: inclui planejamento; especificação, parametrização e configuração; verificação; relatório e liberação para uso.
- Operação: depois de liberado, deve-se manter a conformidade e a adequação ao uso do sistema, com atualização de dados, treinamento, manutenção;
- Descontinuidade: caracteriza-se pela retirada do sistema, disposição e migração dos dados necessários.
Basicamente, o Ciclo de Documentos de um sistema Classificação 3 da ANVISA se constitui de tópicos necessários e detalhados para tornar o seu sistema validável, que são:
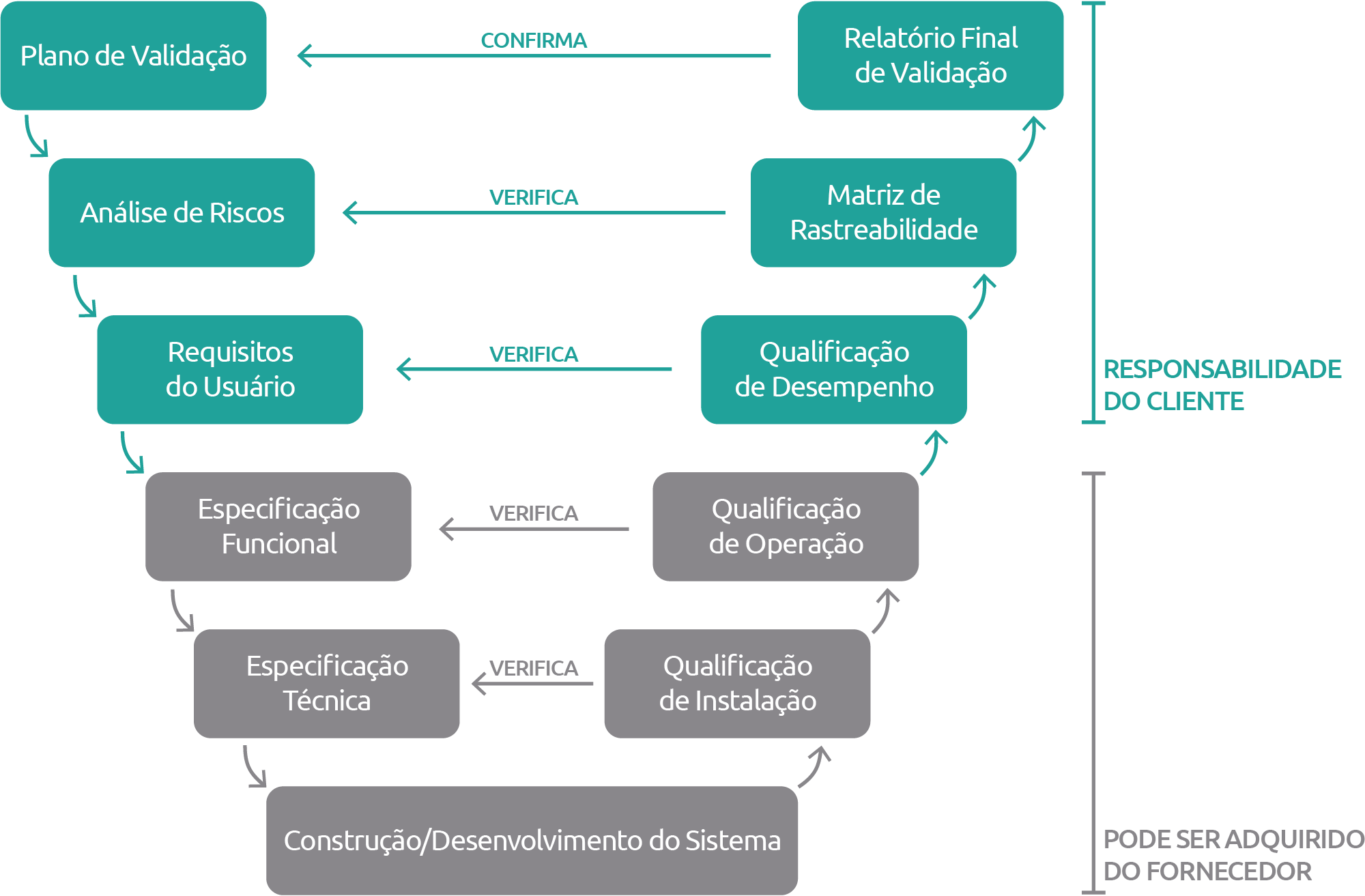
Estes são alguns dos tópicos que compõem o processo de documentação referente à um sistema validável. Retornaremos a este assunto em outros posts para detalhar ainda mais qual a sua aplicação real e necessidades, além de exemplos práticos de como um software ou mesmo uma plataforma online como a Sensorweb pode junto com você passar por essa “prova” de fogo, otimizando diariamente a vida da equipe, os processos, gerando qualidade e possibilitando melhores resultados dentro da instituição.
Destaque sua dúvida, deixe o seu comentário logo abaixo.



Deixe uma resposta
Quer entrar na discussão?Sinta-se livre para contribuir!